As pesquisas clínicas que servem de base para aprovar novos remédios e para que os médicos escolham como tratar seus pacientes omitem dados que poderiam mudar suas conclusões.
Em sua mais recente edição, o periódico "British Medical Journal" analisa a falta de dados relevantes em artigos sobre pesquisas feitas com seres humanos.
O editorial da revista classifica essa falha como uma das mais graves violações éticas do processo de formação de conhecimento sobre novos medicamentos.
Em uma série de análises sobre o tema, o "BMJ" mostra que a omissão de informações muda o resultado de estudos que vão servir para aprovar novas drogas. Isto é, um remédio é avaliado como mais ou menos eficaz, dependendo dos dados do estudo.
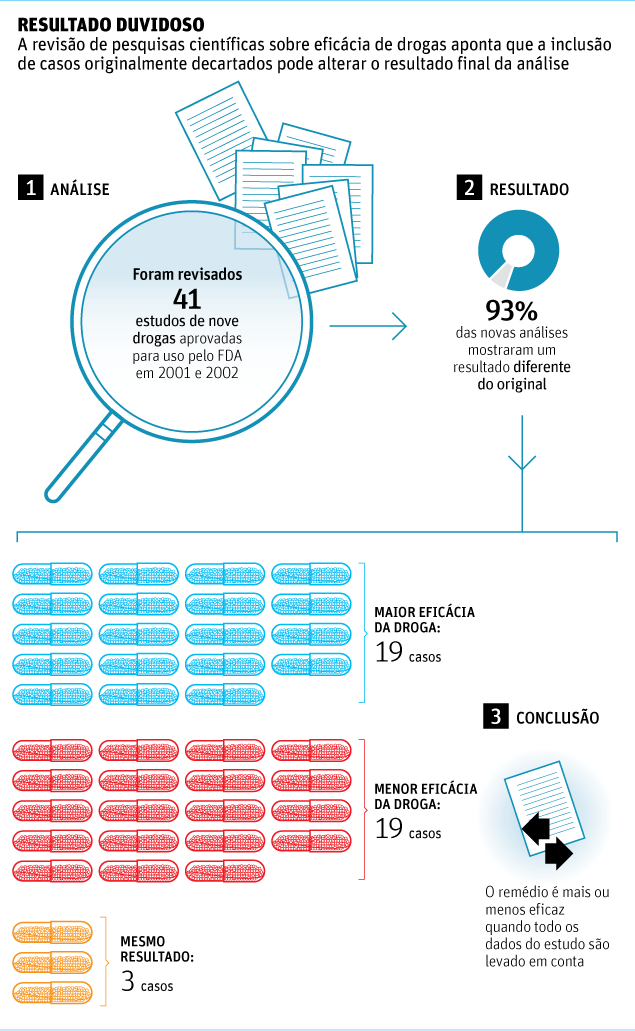
Um dos levantamentos revisou o resultado de 41 estudos sobre novas drogas. Os autores refizeram as conclusões dos testes, incluindo dados de pacientes do grupo inicial de estudo, mas que, por qualquer razão, haviam sido excluídos da análise final.
Em 93% dos casos, o resultado encontrado pelo novo estudo foi diferente do original. Os pesquisadores, por exemplo, mostraram que uma droga contra Alzheimer, a galantamina, foi menos eficaz quando todas informações colhidas nos estudos originais foram consideradas.
Muitas vezes, estudos excluem pacientes por terem idade avançada ou sintomas não relacionados à doença estudada. Tudo isso torna a pesquisa e suas conclusões mais distantes da vida real.
"A maioria dos médicos acredita que o sistema regulatório aplicado a pesquisas em humanos garante que as descobertas sejam relevantes e confiáveis. É um choque ver que isso está longe da realidade", diz a revista.
ÉTICA
O principal responsável pelo problema é o "viés de publicação", como é conhecida a tendência de pesquisadores de selecionar só dados que corroborem sua hipótese, e não os que a negam ou sejam inconclusivos.
"Mesmo subconscientemente, o pesquisador pode ser induzido a encontrar resultados que estejam de acordo com suas expectativas", afirma o reumatologista Marcelo Schafranski.
Uma das formas de combater esse viés é a exigência de que as pesquisas sejam registradas em bancos de dados de acesso público em que ficam disponíveis todas as informações sobre o estudo.
No Brasil, só há um banco desse tipo. O Rebec (Registro Brasileiro de Ensaios Clínicos) é gerido pela Fundação Oswaldo Cruz e resultado de uma parceria com o Ministério da Saúde e a Organização Pan-Americana de Saúde.
"O registro dá transparência à pesquisa. Qualquer pessoa tem informações sobre o estudo", diz o coordenador do Rebec, Josué Laguardia.
Criado há pouco mais de um ano e com inscrição voluntária, o sistema tem 77 pesquisas cadastradas.
Para Laguardia, essa preocupação com a transparência dos dados ainda não é muito disseminada no país.
E só o registro não é garantia contra as distorções. "Dependemos da ética individual do pesquisador",
As pesquisas clínicas que servem de base para aprovar novos remédios e para que os médicos escolham como tratar seus pacientes omitem dados que poderiam mudar suas conclusões.
Em sua mais recente edição, o periódico "British Medical Journal" analisa a falta de dados relevantes em artigos sobre pesquisas feitas com seres humanos.
O editorial da revista classifica essa falha como uma das mais graves violações éticas do processo de formação de conhecimento sobre novos medicamentos.
Em uma série de análises sobre o tema, o "BMJ" mostra que a omissão de informações muda o resultado de estudos que vão servir para aprovar novas drogas. Isto é, um remédio é avaliado como mais ou menos eficaz, dependendo dos dados do estudo.
Um dos levantamentos revisou o resultado de 41 estudos sobre novas drogas. Os autores refizeram as conclusões dos testes, incluindo dados de pacientes do grupo inicial de estudo, mas que, por qualquer razão, haviam sido excluídos da análise final.
Em 93% dos casos, o resultado encontrado pelo novo estudo foi diferente do original. Os pesquisadores, por exemplo, mostraram que uma droga contra Alzheimer, a galantamina, foi menos eficaz quando todas informações colhidas nos estudos originais foram consideradas.
Muitas vezes, estudos excluem pacientes por terem idade avançada ou sintomas não relacionados à doença estudada. Tudo isso torna a pesquisa e suas conclusões mais distantes da vida real.
"A maioria dos médicos acredita que o sistema regulatório aplicado a pesquisas em humanos garante que as descobertas sejam relevantes e confiáveis. É um choque ver que isso está longe da realidade", diz a revista.
THIAGO FERNANDES
Em sua mais recente edição, o periódico "British Medical Journal" analisa a falta de dados relevantes em artigos sobre pesquisas feitas com seres humanos.
O editorial da revista classifica essa falha como uma das mais graves violações éticas do processo de formação de conhecimento sobre novos medicamentos.
Em uma série de análises sobre o tema, o "BMJ" mostra que a omissão de informações muda o resultado de estudos que vão servir para aprovar novas drogas. Isto é, um remédio é avaliado como mais ou menos eficaz, dependendo dos dados do estudo.
Um dos levantamentos revisou o resultado de 41 estudos sobre novas drogas. Os autores refizeram as conclusões dos testes, incluindo dados de pacientes do grupo inicial de estudo, mas que, por qualquer razão, haviam sido excluídos da análise final.
Em 93% dos casos, o resultado encontrado pelo novo estudo foi diferente do original. Os pesquisadores, por exemplo, mostraram que uma droga contra Alzheimer, a galantamina, foi menos eficaz quando todas informações colhidas nos estudos originais foram consideradas.
Muitas vezes, estudos excluem pacientes por terem idade avançada ou sintomas não relacionados à doença estudada. Tudo isso torna a pesquisa e suas conclusões mais distantes da vida real.
"A maioria dos médicos acredita que o sistema regulatório aplicado a pesquisas em humanos garante que as descobertas sejam relevantes e confiáveis. É um choque ver que isso está longe da realidade", diz a revista.
| Editoria de Arte/Folhapress | ||
 |
O principal responsável pelo problema é o "viés de publicação", como é conhecida a tendência de pesquisadores de selecionar só dados que corroborem sua hipótese, e não os que a negam ou sejam inconclusivos.
"Mesmo subconscientemente, o pesquisador pode ser induzido a encontrar resultados que estejam de acordo com suas expectativas", afirma o reumatologista Marcelo Schafranski.
Uma das formas de combater esse viés é a exigência de que as pesquisas sejam registradas em bancos de dados de acesso público em que ficam disponíveis todas as informações sobre o estudo.
No Brasil, só há um banco desse tipo. O Rebec (Registro Brasileiro de Ensaios Clínicos) é gerido pela Fundação Oswaldo Cruz e resultado de uma parceria com o Ministério da Saúde e a Organização Pan-Americana de Saúde.
"O registro dá transparência à pesquisa. Qualquer pessoa tem informações sobre o estudo", diz o coordenador do Rebec, Josué Laguardia.
Criado há pouco mais de um ano e com inscrição voluntária, o sistema tem 77 pesquisas cadastradas.
Para Laguardia, essa preocupação com a transparência dos dados ainda não é muito disseminada no país.
E só o registro não é garantia contra as distorções. "Dependemos da ética individual do pesquisador",
As pesquisas clínicas que servem de base para aprovar novos remédios e para que os médicos escolham como tratar seus pacientes omitem dados que poderiam mudar suas conclusões.
Em sua mais recente edição, o periódico "British Medical Journal" analisa a falta de dados relevantes em artigos sobre pesquisas feitas com seres humanos.
O editorial da revista classifica essa falha como uma das mais graves violações éticas do processo de formação de conhecimento sobre novos medicamentos.
Em uma série de análises sobre o tema, o "BMJ" mostra que a omissão de informações muda o resultado de estudos que vão servir para aprovar novas drogas. Isto é, um remédio é avaliado como mais ou menos eficaz, dependendo dos dados do estudo.
Um dos levantamentos revisou o resultado de 41 estudos sobre novas drogas. Os autores refizeram as conclusões dos testes, incluindo dados de pacientes do grupo inicial de estudo, mas que, por qualquer razão, haviam sido excluídos da análise final.
Em 93% dos casos, o resultado encontrado pelo novo estudo foi diferente do original. Os pesquisadores, por exemplo, mostraram que uma droga contra Alzheimer, a galantamina, foi menos eficaz quando todas informações colhidas nos estudos originais foram consideradas.
Muitas vezes, estudos excluem pacientes por terem idade avançada ou sintomas não relacionados à doença estudada. Tudo isso torna a pesquisa e suas conclusões mais distantes da vida real.
"A maioria dos médicos acredita que o sistema regulatório aplicado a pesquisas em humanos garante que as descobertas sejam relevantes e confiáveis. É um choque ver que isso está longe da realidade", diz a revista.
FOLHA

Nenhum comentário:
Postar um comentário