Gary L. Schwartz, MD, FACP, FAHA, FASH*
Consultant, Division of Nephrology and Hypertension, Professor of Medicine, School of Medicine, Mayo Clinic, Rochester, MN
Artigo original: Lockshin MD. Hypertension. ACP Medicine. 2010;1-28.
[The
original English language work has been published by DECKER
INTELLECTUAL PROPERTIES INC. Hamilton, Ontario, Canada. Copyright © 2011
Decker Intellectual Properties Inc. All Rights Reserved.]
* O autor e os editores agradecem as contribuições de Sheldon G. Shepps, MD, FACP, autor da edição anterior deste capítulo, para o desenvolvimento e redação deste texto.
Tradução: Soraya Imon de Oliveira
Revisão técnica: Dr. Euclides Furtado de Albuquerque Cavalcanti
A hipertensão é o distúrbio crônico mais comum nos Estados Unidos; afeta mais de 29% da população adulta.1
Sua prevalência aumenta com o avanço da idade: para um indivíduo
normotenso de meia-idade que vive nos Estados Unidos, o risco de
desenvolver hipertensão ao longo da vida é de aproximadamente 90%.2
Com o envelhecimento das populações nos países mais desenvolvidos e nas
sociedades em desenvolvimento, a hipertensão tende a se tornar um
distúrbio cada vez mais prevalente nos próximos anos.
A
hipertensão constitui um dos principais fatores de risco para
desenvolvimento de acidente vascular cerebral (AVC), infarto do
miocárdio, insuficiência cardíaca, doença renal crônica, aterosclerose
progressiva e demência.3 O tratamento da hipertensão é altamente efetivo em termos de redução da morbidade e mortalidade cardiovascular (CV).4
Nos últimos 10 anos, como resultado da ampla disseminação pública e
profissional dos conhecimentos acerca dos riscos da hipertensão e dos
benefícios proporcionados pelo tratamento, bem como sobre a crescente
disponibilidade de terapias efetivas, o tratamento e as taxas de
controle da hipertensão apresentaram melhora. Atualmente, 73% dos
adultos com hipertensão recebem tratamento, e 50% dos casos estão
controlados.1 Numerosos fatores contribuem para o controle inadequado da hipertensão.5
A melhora contínua das taxas de controle depende do estabelecimento
pelos profissionais da saúde de metas terapêuticas baseadas em
evidências, paciente-específicas e apropriadas, bem como do conhecimento
e utilização das opções de tratamento disponíveis, de forma eficiente e
custo-efetiva, além do envolvimento empático do paciente no
estabelecimento das metas e no processo de tratamento e da instituição
de seguimento a intervalos de tempo adequados para monitorar e ajustar a
terapia de acordo com a necessidade. É importante reconhecer que
múltiplas classes de fármacos são frequentemente necessárias para o
controle; a educação, comunicação e envolvimento do paciente no processo
são vitais à complacência a longo prazo; e as abordagens sistemáticas
de terapia são necessárias para alcançar e manter o controle ao longo do
tempo.
Definição
A
pressão arterial (PA) representa um traço quantitativo distribuído de
maneira contínua junto à população. A hipertensão representa os valores
de PA correspondentes ao limite superior desta distribuição. Entretanto,
sua definição é arbitrária, porque o risco de doença CV relacionado ao
nível de PA aumenta de gradativamente ao longo do espectro de valores de
PA. Com base em estudos de metanálise relacionando o nível de PA à
mortalidade vascular, uma PA ideal é definida como sendo inferior a
115/75 mmHg.6 De acordo com o Seventh Report of the
Joint National Committee on Prevention, Detection, Evaluation, and
Treatment of High Blood Pressure (JNC 7), a PA normal (o nível associado
a um risco mínimo) para adultos com 18 anos de idade ou mais
corresponde a uma PA sistólica inferior a 120 mmHg e a uma PA diastólica
abaixo de 80 mmHg [Tabela 1].7
PAs que variam entre 120 e 139 mmHg em sístole ou 80 e 89 mmHg em
diástole são consideradas pré-hipertensivas. Adultos com PA nesta faixa
apresentam risco aumentado de desenvolvimento de doença CV prematura e
de progressão para uma hipertensão definida com o passar do tempo.6,8
Por isso, recomenda-se que indivíduos com pré-hipertensão passem por
checagens anuais de PA e sejam ensinados a usar estratégias para
diminuir a PA e o risco CV, assim como para prevenir o desenvolvimento
da hipertensão [Prevenção da hipertensão, adiante]. Para a população em
geral, a hipertensão é definida como uma PA sistólica = 140 mmHg ou uma
PA diastólica = 90 mmHg; soma-se a isto a subdivisão em 2 tipos, com
base no nível sistólico ou diastólico que os classifica no estágio mais
alto. A hipertensão sistólica isolada (HSI), que ocorre principalmente
em pessoas com mais de 55 anos, é definida como por uma PA sistólica =
140 mmHg e uma PA diastólica < 90 mmHg. A HSI constitui o subtipo
mais comum de hipertensão entre os adultos de idade mais avançada, os
quais representam o segmento populacional de crescimento mais rápido.
Tabela 1. Classificação da PA para adultos com idade a partir de 18 anos
Categoria
|
Nível de PA (mmHg)
|
Normal
|
Sistólica < 120; diastólica < 80
|
Pré-hipertensão
|
Sistólica: 120 a 139; diastólica 80 a 89
|
Hipertensão
|
|
Estágio 1
|
Sistólica: 140 a 159; diastólica 90 a 99
|
Estágio 2
|
Sistólica = 160; diastólica = 100
|
Estas
categorias se aplicam aos pacientes que não estejam tomando fármacos
anti-hipertensivos nem estejam com doença aguda. Quando as pressões
arteriais (PA) sistólica e diastólica caem em categorias distintas,
deve-se considerar a categoria mais alta para classificar o status
pressórico do paciente.
PA = pressão arterial.
Epidemiologia
Nas
sociedades desenvolvidas, a PA aumenta com o avanço da idade. A PA
diastólica atinge o platô durante a 5ª década da vida e, a partir daí,
pode começar a declinar. No entanto, a PA sistólica continua subindo até
a 7ª década da vida. Dessa forma, tanto a incidência como a prevalência
da hipertensão aumentam com o avanço da idade, sendo a HSI o subtipo
mais comum entre idosos.
Além
da idade, outros fatores de risco para o desenvolvimento de hipertensão
incluem afrodescendência e história familiar de hipertensão. Os fatores
de risco reversíveis são a PA na faixa pré-hipertensiva, obesidade (85%
dos casos de hipertensão envolvem pacientes adultos com um índice de
massa corporal [IMC] > 25 kg/m2), estilo de vida sedentário, consumo excessivo de bebidas alcoólicas e dieta com alto teor de sódio e pobre em potássio.7,9
A síndrome metabólica representa um agrupamento de fatores de risco CV
encontrado mais comumente em indivíduos com PA elevada, que resulta em
um perfil de alto risco CV.7,10 É definida pela presença de 3
ou mais dos seguintes fatores: obesidade abdominal (circunferência da
cintura > 100 cm em homens, ou > 88 cm em mulheres), glicemia de
jejum elevada (= 100 mg/dL), PA elevada (= 130/85 mmHg), níveis
plasmáticos de triglicerídeos elevados (= 150 mg/dL) ou baixos níveis de
HDL (< 40 mg/dL em homens, ou < 50 mg/dL em mulheres).
Em
indivíduos com menos de 50 anos de idade, o nível de PA diastólica
constitui o principal fator preditor do risco CV. Em pessoas com mais de
60 anos, este fator é a PA sistólica.11 O risco individual
está relacionado ao nível e à duração da PA, bem como à existência de
outros fatores de risco e de lesão em órgãos-alvo – cérebro, coração,
rins, artérias periféricas e retina.12
A
relação existente entre PA e morbidade e mortalidade CV surge em
pacientes cuja PA está acima dos níveis ideais (115/75 mmHg), sendo
forte, contínua, gradativa, consistente e independente. A relação
existente entre PA e risco CV foi amplamente determinada em indivíduos
de meia-idade e idosos, porém a PA acima do normal durante a fase de
adulto jovem também está relacionada a uma maior mortalidade por causas
diversas e por CV a longo prazo.13
Durante
a fase de adulto jovem e na meia-idade, a hipertensão é mais comum em
homens do que em mulheres, contudo ocorre o oposto a partir dos 60 anos.1
Em todas as idades, a hipertensão é mais comum em afrodescendentes do
que entre brancos. Em todos os grupos étnicos e raciais, a condição é
mais frequente entre os menos financeiramente favorecidos. Em dado nível
de PA, o risco CV é maior entre homens do que em mulheres, maior em
afrodescendentes do que em brancos ou membros de outros grupos raciais
ou étnicos, maior entre idosos do que entre jovens, e maior em pacientes
com doença em órgãos-alvo e hipertensão de maior duração.12
Etiologia e genética
A
hipertensão essencial desenvolve-se ao longo do tempo, como
consequência de uma interface complexa entre genes de suscetibilidade e
fatores ambientais. Numerosos estudos familiares e populacionais sugerem
que fatores genéticos exercem um papel significativo. Em comparação aos
indivíduos normotensos, aqueles com hipertensão são 4 vezes mais
propensos a terem história familiar de hipertensão. Estima-se que a
contribuição genética para a variação da PA esteja na faixa de 30 a 50%.14
Entretanto, a contribuição genética para o desenvolvimento da
hipertensão essencial é complexa. Múltiplos genes influenciam a PA, e
seus efeitos provavelmente envolvem tanto a interação gene/gene
(epistasia) como a interação gene/ambiente. Interações importantes entre
efeitos de genes específicos e ambientes podem ocorrer em um
determinado momento ou ao longo da vida do indivíduo, como no período
pré-natal, por exemplo. Um aspecto adicional que representa um desafio à
compreensão da contribuição genética para a hipertensão inclui a
probabilidade de o distúrbio resultar do efeito líquido produzido por
genes que elevam e diminuem a PA. Portanto, selecionar a contribuição
genética para o desenvolvimento da hipertensão essencial é uma tarefa
complexa e desafiadora.
Foram
propostas algumas hipóteses a respeito da contribuição genética para a
hipertensão essencial, a partir da identificação de formas raras e
monogênicas de hipertensão.15 Notavelmente, a maioria destes
distúrbios surge de mutações genéticas que resultam no comprometimento
da excreção de sódio renal. Este comprometimento se dá pela interrupção
dos sistemas de transporte de sódio renal ou via interferência na
atividade dos receptores de mineralocorticoides.
Hipóteses
adicionais resultaram de estudos que usaram uma abordagem baseada em
gene candidato, em que os genes a serem investigados foram escolhidos
com base em estudos realizados com animais ou considerando o
conhecimento preexistente sobre genes codificadores de proteínas
envolvidas em vias regulatórias de PA conhecidas. Os polimorfismos
exibidos pelos genes candidatos foram analisados em estudos de
associação (indivíduos sem parentesco) e ligação (famílias ou pares de
gêmeos), cujo objetivo era avaliar seus papéis em potencial na
hipertensão essencial.
Os
avanços tecnológicos recentes possibilitaram medir milhares de
polimorfismos genéticos ao longo de todo o genoma e avaliar sua
associação com a hipertensão.16 Estes estudos de associação
genômica ampla têm o potencial de identificar genes envolvidos em vias
fisiológicas novas, anteriormente desconhecidas, de regulação da PA.
Entretanto, até agora, os estudos de associação genômica ampla para
identificação de novos loci genéticos envolvidos no risco de hipertensão
obtiveram resultados desapontadores.17 Apesar de vários loci
novos terem sido descobertos recentemente, estes loci juntos explicam
apenas 1% da variação de PA observada na população.18,19 No
momento, os estudos genéticos em curso ainda não atingiram um nível de
prática clínica informativa na hipertensão. Existe uma necessidade
contínua de abordagens novas para decifrar a contribuição genética ao
desenvolvimento de hipertensão essencial.
Com
relação ao papel da genética na hipertensão, é importante notar que ela
praticamente inexiste nas populações primitivas que seguem um estilo de
vida de caça-coleta pré-agrícola. Este estilo de vida envolve um nível
significativo de atividade física diária e uma dieta rica em potássio e
pobre em gordura e sódio. A obesidade é incomum. Os padrões alimentares
envolvem períodos de jejum intercalados com longos períodos de consumo
mínimo de comida. Considerando que o pool de genes humanos sofreu poucas
mudanças nos últimos 30.000 anos, foi sugerido que a hipertensão é
consequência de um genoma humano selecionado para um estilo de vida de
caça-coleta, mas que atualmente interage com um estilo de vida moderno.
Em contraste com as sociedades primitivas, as sociedades modernas são
caracterizadas por um baixo nível de atividade física e pela constante
disponibilidade de comida abundante, a qual é rica em sódio e gordura,
mas pobre em potássio. O resultado é o aumento do peso corporal com o
avanço da idade e a alta incidência de obesidade. A adaptação genética
ao estilo de vida de caça-coleta proporcionou vantagens em termos de
sobrevida no ambiente, mas agora pode estar contribuindo para o
desenvolvimento de muitas doenças modernas, como a obesidade e a
hipertensão. A caracterização de fatores ambientais e genes de
suscetibilidade, bem como suas interações ao longo da vida causadoras de
hipertensão, constitui uma tarefa hercúlea.
Patofisiologia e patogênese
De
modo simplista, pode-se dizer que a PA é o produto do débito cardíaco e
da resistência vascular periférica (PA = débito cardíaco × resistência
vascular periférica). Dessa forma, variações do volume de líquido
extracelular, estado contrátil cardíaco e tônus vascular determinam o
nível de variação da PA. A principal característica hemodinâmica da
hipertensão essencial estabelecida é a elevada resistência vascular
periférica. Um aumento do débito cardíaco é ocasionalmente observado no
início, porém não representa um achado persistente. A hipertensão pode
ser vista como sendo o resultado final de uma interação complexa entre
fatores genéticos e ambientais que atuam sobre os sistemas fisiológicos
intermediários envolvidos na regulação da PA (isto é, aqueles que
influenciam o volume de líquido, a contratilidade cardíaca e o tônus
vascular).
Uma
hipótese importante para a patogênese da hipertensão essencial envolve
uma interação entre a ingesta de uma dieta rica em sódio, típica das
sociedades industrializadas, e defeitos de excreção de sódio renal. As
evidências do papel exercido pelo sódio da dieta são fornecidas por
estudos realizados com animais e por estudos epidemiológicos e
experimentais envolvendo seres humanos.9 Guyton hipotetizou
que o desenvolvimento de hipertensão ocorre quando os rins passam a
necessitar de uma PA mais alta para manter o volume extracelular dentro
dos limites normais.20 Isto poderia ocorrer em indivíduos com
excreção de sódio renal comprometida. Evidências sustentam a
possibilidade de um defeito hereditário de excreção de sódio renal
servir de base para o desenvolvimento de hipertensão essencial. Conforme
observado anteriormente, a maioria das formas de hipertensão já
descobertas envolvem mutações que comprometem a excreção renal de sódio
ao promoverem aumento da atividade mineralocorticoide ou influenciarem
os sistemas de transporte tubular de sódio.15 A excreção de
sódio renal também pode ser influenciada por variações da atividade do
sistema da renina-angiotensina-aldosterona e do sistema nervoso
simpático. A angiotensina II intensifica a reabsorção tubular renal de
sódio direta e indiretamente, via estimulação da liberação de
aldosterona e do sistema nervoso simpático. Entre os mecanismos
adicionais que podem explicar a excreção renal de sódio defeituosa estão
a redução hereditária do número de néfrons e a presença de uma
subpopulação de néfrons isquêmicos, que resultam do aumento do tônus da
artéria renal aferente e promovem aumento da produção de renina. A
expansão do volume extracelular, por sua vez, poderia levar a aumentos
crônicos da resistência vascular através de mecanismos orgânicos de
autorregulação do fluxo sanguíneo (isto é, a variação do tônus dos vasos
que promove a regulação do fluxo sanguíneo para atender às necessidades
metabólicas). Por fim, a expansão do volume pode estimular a liberação
contrarregulatória de inibidor de sódio-potássio-adenosina trifosfatase –
Na+/K+/ATPase –, (ou seja, uma substância análoga à ouabaína), que
facilita a excreção renal de sódio, mas, ao mesmo tempo, aumenta o tônus
vascular ao interferir na troca de sódio-cálcio ao nível das células da
musculatura lisa vascular.
Outras
evidências sugerem que um aumento primário da atividade do sistema
nervoso simpático exerce papel causal na hipertensão. O distúrbio
poderia surgir de uma predisposição genética a uma reatividade simpática
aumentada, interagindo com estresses psicogênicos repetitivos,
obesidade ou ingesta elevada de sódio. A hipertensão também poderia
surgir ou ser sustentada por defeitos envolvendo a função dos
barorreceptores.
O
ganho de peso e a obesidade (especialmente o acúmulo de gordura
abdominal) estão associados ao risco aumentado de hipertensão. Alguns
fatores humorais podem ser responsáveis pela mediação dos aumentos de
atividade do sistema nervoso simpático e do sistema da
renina-angiotensina. A obesidade está associada à resistência à insulina
e à hiperinsulinemia. Esta última, por sua vez, pode estimular
diretamente a atividade simpática e promover hipertrofia vascular (tônus
vascular aumentado), bem como retenção de sódio renal. Além disso, os
níveis de leptina estão aumentados em indivíduos obesos. A leptina
também pode aumentar a PA por meio de seus efeitos estimulatórios sobre o
sistema nervoso simpático.
Anormalidades
mais gerais envolvendo membranas celulares ou múltiplos sistemas de
transporte de íons atuando através das membranas celulares poderiam
contribuir para o desenvolvimento da hipertensão. Além de comprometer a
excreção de sódio nos rins, estes defeitos poderiam atuar de diversas
formas para influenciar a estrutura e o tônus vascular. O tônus vascular
também poderia ser influenciado por alterações na função do endotélio
vascular, em decorrência de um desequilíbrio na produção de substâncias
causadoras de vasodilatação (p. ex., óxido nítrico) e de vasoconstrição
(p. ex., endotelina).
Nos
últimos anos, tem havido um interesse crescente no papel da progressiva
rigidez da aorta e de seus ramos principais como causa de elevação
progressiva da PA sistólica que ocorre com o avanço da idade.21
Em indivíduos mais jovens, a aorta é elástica e expande-se conforme o
sangue é ejetado em seu interior, durante a sístole. Este sangue retido,
então, é transmitido para a periferia durante a diástole, sustentando a
PA diastólica. À medida que a aorta e seus ramos principais enrijecem,
de maneira associada ao envelhecimento e outros fatores, a aorta passa a
se dilatar menos durante a sístole. Isto gera maior pressão sistólica.
Em adição, como mais sangue é forçado para dentro da periferia durante a
sístole, uma quantidade menor fica disponível durante a diástole, e,
assim, a pressão diastólica diminui. Este processo causa o conhecido
aumento da pressão de pulso (isto é, a diferença entre as PA sistólica e
diastólica) com o avanço da idade. Além disso, conforme o sangue é
injetado dentro da aorta, uma onda de pressão para a frente é gerada e
segue pelo vaso até a periferia. Esta onda para a frente é parcialmente
refletida nos pontos de ramificação vascular e pelos vasos menores na
periferia. Estes reflexos se somam para formar uma onda de pressão
composta refletida, que retorna para a aorta central durante a fase
final da sístole ou no começo da diástole, e é referida como pressão de
aumento. A velocidade da onda de pulso para a frente aumenta com o
enrijecimento aórtico progressivo. Em consequência, a onda refletida
(isto é, a pressão de aumento) chega mais cedo na aorta central e, com
isso, aumenta o pico de pressão aórtica central.22
Diagnóstico
O
diagnóstico da hipertensão baseia-se em múltiplas medidas da PA tomadas
no consultório, de maneira rigorosa, com auxílio de um esfigmomanômetro
oscilométrico, aneroide ou de mercúrio e um manguito de tamanho
apropriado (a câmara de ar do manguito deve circundar 80% da porção
superior do braço). Embora estejam disponíveis, as diretrizes para
determinação correta da PA raramente são cumpridas junto à maioria das
práticas [Tabela 2].23
O diagnóstico da hipertensão requer um valor alto de PA média em pelo 2
consultas, com no mínimo 2 medidas padronizadas de PA tomadas a cada
consulta. Na maioria dos casos, a confirmação pode ser obtida dentro de
um período de 1 a 2 meses. Quando uma PA inicial está seriamente
elevada, a confirmação deve ser feita em um período menor.
Tabela 2. Técnica correta de medição da PA
O paciente deve abster-se de fumar ou ingerir cafeína durante 30 min, antes da medição
|
O
paciente deve permanecer em repouso, sentado em uma cadeira com as
costas e os pés devidamente apoiados, durante no mínimo 5 min, antes da
medição
|
O paciente não deve conversar durante a medição
|
O braço do paciente deve estar descoberto, sem roupas apertadas comprimindo a parte superior
|
Deve-se
escolher um manguito de tamanho adequado para o braço do paciente: a
câmara de ar deve circundar pelo menos 80% do braço (muitos adultos
necessitam de um manguito maior)
|
Posicione o braço do paciente de modo que o manguito fique ao nível do coração
|
Coloque o sino do estetoscópio sobre a artéria braquial
|
Infle o manguito para ocluir a pulsação
|
Desinfle a uma velocidade de 2 a 3 mm/s
|
Determine os valores sistólico (1º som) e diastólico (2º som) mais próximos de 2 mmHg
|
Repita a medição após 2 min
|
Em circunstâncias especiais, a PA deve ser medida com o paciente em pé
|
PA = pressão arterial.
Medidas
de PA tomadas pelo próprio paciente, fora do consultório médico, devem
ser recomendadas de maneira rotineira para a maioria dos pacientes com
hipertensão suspeita ou comprovada.24 Para tanto, devem ser
utilizados aparelhos oscilométricos que medem a PA na porção superior do
braço com auxílio de um manguito de tamanho apropriado. Os pacientes
devem ser orientados a obter 3 leituras utilizando a técnica correta [Tabela 2],
de manhã e à noite, durante 1 semana (pelo menos 12 leituras, no
total), antes de comparecerem à consulta. As medidas tomadas pelo
próprio paciente podem ser utilizadas para diferenciar uma hipertensão
sustentada de um caso de hipertensão clínica isolada (Hipertensão do
avental branco; veja adiante). A automedição de PA proporciona as
vantagens adicionais de envolver os pacientes no processo de tratamento
(o que muitas vezes melhora a aderência) e auxiliar na avaliação da
resposta à terapia. Em média, as leituras tomadas em casa são menores do
que aquelas obtidas no consultório. Por isso, valores acima de 135 mmHg
de PA sistólica ou de 85 mmHg de PA diastólica são considerados
elevados. Os aparelhos medidores de PA para uso doméstico devem ser
validados 2 vezes/ano por um prestador de assistência de saúde.
Monitoração ambulatorial da pressão arterial (MAPA)
O
monitoramento ambulatorial da pressão arterial média de 24 horas (MAPA)
é um forte preditor de eventos CV e fornece informação prognóstica
independentemente da medida de PA obtida em consultório.25 O
MAPA é o melhor método para estabelecer a existência de hipertensão
clínica isolada (conhecida como hipertensão do avental branco), definida
como uma elevação da PA que ocorre apenas no cenário clínico, com uma
PA normal em todos os demais contextos, na ausência de evidências
indicadoras de lesão em órgão-alvo.7 O rastreamento para
detecção de casos de hipertensão do avental branco atualmente constitui
uma indicação de MAPA passível de reembolso pelo Medicare (sistema de
seguros de saúde dos Estados Unidos).26 A possibilidade de um
“efeito do avental branco” (PA clínica exagerada em paciente com
hipertensão estabelecida) deve ser considerada em casos de pacientes
selecionados com hipertensão resistente, pacientes idosos com
hipertensão sistólica medida em consultório, e em alguns casos de
mulheres grávidas. Embora a hipertensão do avental branco esteja
associada a um risco menor do que a hipertensão sustentada, constitui um
fator preditor de hipertensão sustentada futura para alguns pacientes.27
Outras utilidades do MAPA incluem a avaliação de sintomas hipotensivos,
hipertensão episódica e disfunção anatômica suspeita em pacientes com
hipotensão postural.7 O MAPA também é útil na avaliação de
pacientes ocasionais, com lesão hipertensiva em órgão-alvo (p. ex., AVC,
hipertrofia ventricular esquerda – HVE), cujos valores de PA obtidos no
consultório são normais ou controlados, quando na vigência de um
tratamento para hipertensão. Alguns destes pacientes apresentam a
conhecida normotensão do avental branco, ou hipertensão mascarada.
Nestes pacientes, a PA permanece normal ou controlada no consultório,
porém aumenta quando o paciente está fora do consultório médico. Este
configura um importante grupo de pacientes, que frequentemente passa
despercebido na prática de rotina. Estima-se que a prevalência da
hipertensão mascarada seja de 8 a 20%, podendo ser maior entre os
pacientes hipertensivos tratados. A hipertensão mascarada está associada
a um risco aumentado de eventos CV, os quais não são previstos pela PA
determinada em consultório.28 A identificação destes
pacientes também pode ser auxiliada pela automedição da PA. Por fim, o
MAPA é a única forma de identificar pessoas que não apresentam os usuais
10 a 20% de declínio da PA que geralmente ocorrem durante o sono.
Indivíduos “nondippers” (cuja pressão não cai adequadamente durante o
sono) apresentam maior risco de desenvolvimento de eventos CV do que os
“dippers” (cuja pressão declina normalmente durante o sono). O caráter
nondipper é mais comum em afrodescendentes, em indivíduos com
hipertensão secundária, doença renal ou apneia do sono obstrutiva, e
após transplante de órgão ou uso crônico de esteroide. Os limites
superiores dos valores normais para MAPA são 130/80 mmHg (média de 24
horas), 135/85 mmHg (durante a vigília) e 120/75 mmHg (durante o sono).29
Avaliação inicial
A
avaliação inicial dos pacientes com PA elevada tem 4 objetivos
principais: (1) identificar fatores relacionados ao estilo de vida que
contribuem para a elevação da PA e para risco aumentado de doença CV;
(2) identificar os fatores de risco CV modificáveis associados; (3)
avaliar o paciente quanto à existência de lesão em órgão-alvo ou doença
clínica CV; e (4) identificar causas secundárias de hipertensão.7
O 2º e o 3º objetivos são importantes para a estratificação do risco.
Nas diretrizes de tratamento vigentes, a determinação do nível de risco
ou a existência de certos fatores de risco (diabetes) ou lesão em
órgão-alvo (doença renal crônica, doença vascular aterosclerótica
comprovada) definem o limiar de PA para instituição da terapia
farmacológica e estabelecem a meta de PA a ser alcançada com a terapia.7,10,30
A
frequência geral da hipertensão secundária é de 5 a 10% nas práticas da
assistência primária. O quadro clássico de hipertensão essencial deve
ser comparado à apresentação individual do paciente [Tabela 3].
A suspeita de hipertensão secundária deve ser levantada diante da
observação de aspectos não consistentes com a hipertensão essencial.
Tais aspectos incluem idade inferior a 30 anos ou acima de 50 anos no
momento da manifestação da condição; PA acima de 180/110 mmHg no momento
do diagnóstico; lesão de órgão-alvo significativa no momento do
diagnóstico; hemorragias e exsudação ao exame de retina; insuficiência
renal; HVE; resposta fraca a uma terapia farmacológica adequada; e
hipertensão acelerada ou maligna. Os aspectos sugestivos de causas
secundárias específicas de hipertensão variam conforme a condição
individual [Tabela 4].
Tabela 3. Aspectos clássicos da hipertensão essencial
Aparecimento da hipertensão na 4ª ou 5ª década da vida
|
História familiar positiva de hipertensão
|
PA < 180/< 110 mmHg no momento do diagnóstico
|
Paciente assintomático
|
História, exame físico e exames laboratoriais de rotina normais (sem dano em órgão-alvo no momento do diagnóstico)
|
O controle da PA é obtido com a modificação do estilo de vida e o uso de 1 ou 2 fármacos
|
O controle da PA é mantido, depois de alcançado
|
PA = pressão arterial.
Tabela 4. Aspectos sugestivos de causas específicas de hipertensão secundária
Condição
|
Aspectos
|
Aldosteronismo primário
|
Hipocalemia não provocada
|
Feocromocitoma
|
PA lábil, com episódios de dor de cabeça, sudorese, taquicardia, palidez, dor abdominal, perda de peso, diabetes
|
Neurofibromas, manchas café-com-leite
| |
Neuromas orofaciais (síndrome de von Hippel-Lindau)
| |
Hipertensão renovascular
|
Sopros abdominais ou no flanco
|
Sopros periféricos/pulsos diminuídos em decorrência de aterosclerose
| |
Níveis séricos de creatinina elevados, hipocalemia
| |
Edema pulmonar inexplicável
| |
Hipertensão em pacientes com menos de 30 anos de idade ou em uma mulher em idade fértil (displasia fibromuscular)
| |
Manifestação repentina ou piora de hipertensão sistólica-diastólica após os 55 anos de idade (doença ateromatosa)
| |
Hipertensão maligna acelerada
| |
Hipertensão resistente ao tratamento
| |
Insuficiência renal aguda com terapia à base de inibidor de ECA/BRA ou redução da PA (elevação > 20% dos níveis de Cr)
| |
Rim inexplicavelmente pequeno
| |
Tamanho renal em assimetria (> 1,5 cm)
| |
Síndrome de Cushing
|
Obesidade truncal, fraqueza muscular proximal e atrofia
|
Estrias, acne, pele fina, contusões, hiperpigmentação
| |
Níveis plasmáticos de glicose elevados, hipocalemia
| |
Coarctação da aorta
|
Dores de cabeça
|
Pés frios, claudicação
| |
Retardo da pulsação femoral, em comparação à pulsação radial
| |
Pulsos femorais fracos ou ausentes
| |
PA elevada nos braços/PA baixa nas pernas
| |
Murmúrios na parte frontal/posterior do tórax
| |
Doença renal policística
|
Massas abdominais/no flanco, história familiar de doença renal
|
BRA = bloqueador do receptor da angiotensina. Cr = creatinina. ECA = enzima conversora de angiotensina. PA = pressão arterial.
História
O
clínico deve fazer perguntas sobre a história familiar de hipertensão,
doença CV precoce e distúrbios que possam aumentar a possibilidade de
hipertensão secundária (p. ex., doença renal policística ou outra doença
renal; câncer medular da tireoide [feocromocitoma hereditário;
neoplasia endócrina múltipla – NEM], hiperparatireoidismo [NEM],
aldosteronismo primário, feocromocitoma). O paciente deve ser
questionado sobre os hábitos de estilo de vida que podem influenciar a
PA (p. ex., nível de atividade física, ingesta de sódio, uso de cafeína e
álcool, história de ganho de peso) e risco CV (p. ex., tabagismo). Além
disso, o paciente deve ser interrogado sobre os sintomas sugestivos de
doença orgânica (p. ex., angina, sintomas de insuficiência cardíaca,
isquemia cerebral transitória ou doença renal) ou hipertensão secundária
(p. ex., crises sugestivas de feocromocitoma). Uma história conhecida
de dislipidemia, diabetes ou doença cerebrovascular, cardíaca ou renal
também deve ser documentada. Também é importante revisar totalmente a
medicação (incluindo o uso de fármacos prescritos e de medicação sem
prescrição, ervas e compostos naturais, bem como drogas ilícitas), a fim
de identificar fármacos capazes de aumentar a PA ou interferir no
efeito anti-hipertensivo da terapia farmacológica planejada [Tabela 5].
No caso de pacientes com história de hipertensão, o médico deve
descobrir a duração da hipertensão, os níveis anteriores de PA e os
fármacos especificamente utilizados no tratamento, bem como a eficácia
destes fármacos e os motivos que levaram à suspensão de seu uso. Outras
razões envolvendo comorbidades e seus respectivos tratamentos precisam
ser documentadas, pois podem influenciar na escolha do fármaco
anti-hipertensivo.
Tabela 5. Fármacos capazes de aumentar a PA ou influenciar a eficácia do fármaco anti-hipertensivo
Fármacos
|
Mecanismos
|
Anticoncepcionais orais
|
Retenção de sódio; aumenta os níveis de angiotensinogênio, facilitando a ação das catecolaminas
|
Álcool (consumo moderado ou excessivo)
|
Ativa o sistema nervoso simpático; aumenta a secreção de cortisol e os níveis intracelulares de cálcio
|
Simpatomiméticos
e substâncias análogas da anfetamina (fármacos vendidos sem prescrição
médica para tratamento de alergias e gripes, comprimidos para dieta)
|
Aumenta a resistência vascular periférica
|
Fármacos anti-inflamatórios não hormonais
|
Retenção
de sódio, vasoconstrição renal; interfere na eficácia de todos os
fármacos anti-hipertensivos, em especial diuréticos, betabloqueadores,
inibidores de enzima conversora de angiotensina e bloqueadores do
receptor de angiotensina
|
Corticosteroides
|
Síndrome de Cushing iatrogênica
|
Antidepressivos tricíclicos
|
Inibe a ativação dos simpatolíticos de ação central (clonidina, guanfacina)
|
Serotoninérgicos (antidepressivos)
|
Vasoconstrição sistêmica (aumenta a resistência vascular periférica)
|
Ciclosporina
|
Vasoconstrição renal e sistêmica (retenção de sódio, resistência vascular periférica aumentada)
|
Eritropoetina
|
Vasoconstrição sistêmica (resistência vascular periférica aumentada)
|
Inibidores de monoamina oxidase + alimentos contendo tiramina (queijos envelhecidos, vinho tinto)
|
Previne a degradação da noradrenalina liberada por alimentos contendo tiramina; aumento da PA por ação da reserpina
|
Bevacizumabe
|
Diminuição da síntese de óxido nítrico endotelial e rarefação de microvasos em diversos tecidos
|
Cocaína
|
Vasoconstrição sistêmica (resistência vascular periférica aumentada)
|
Maconha
|
Aumenta a PA sistólica
|
Ácido glicirrízico (fumo, alcaçuz importado, produtos alimentícios)
|
Inibe
o metabolismo do cortisol em cortisona (atividade mineralocorticoide
aumentada, causando retenção de sódio, perda de potássio)
|
Produtos à base de grapefruit (toranja)
|
Inibe o metabolismo de alguns fármacos pelo citocromo P-450
|
Plantas medicinais
|
|
Sanguinaria canadenses (erva-impigem)
|
Estimulante do SNC
|
Cimicifuga racemosa (blue cohosh)
|
Ação de metilcitosina
|
Feijão-fava
|
Ação desconhecida
|
Sarothamnus scoparius (giesta)
|
Simpatomimético
|
Noz de cola
|
Simpatomimético
|
Éfedra
|
Simpatomimético, estimulante do SNC
|
Digital
|
Inotropo cardíaco
|
Genciana
|
Ação desconhecida
|
Ginseng
|
Estimulante do SNC, efeito de glicocorticoide
|
Hidraste
|
Vasoconstrição sistêmica
|
Grindélia
|
Estimulante do SNC
|
Estramônio
|
Efeito anticolinérgico
|
Junípero
|
Aquerético
|
Piper methysticum
|
Ação desconhecida
|
Corynanthe yohimbe
|
Alfabloqueador central
|
PA = pressão arterial. SNC = sistema nervoso central.
Exame físico
O
exame deve incluir ao menos 2 medidas padronizadas de PA, tomadas com o
paciente sentado. A princípio, a PA também deve ser medida no braço
oposto (para identificar o estreitamento arterial, que pode produzir uma
leitura incorretamente baixa em um dos braços) e com o paciente em pé,
sobretudo no caso de pacientes diabéticos e idosos (para identificar
quedas ortostáticas). A altura e o peso devem ser determinados para
permitir o cálculo do IMC, e também deve ser registrada a medida da
circunferência da cintura (um potencial fator de risco CV; ver a
discussão sobre síndrome metabólica na seção Epidemiologia).
O exame físico é voltado para a identificação de lesões em órgãos-alvo ou aspectos sugestivos de hipertensão secundária [Tabela 4].
Um exame de retina deve ser realizado, principalmente para identificar
alterações resultantes do diabetes ou de hipertensão severa (ou seja,
hemorragias, exsudatos, papiledema). O estreitamento arteriolar,
constrições focais e entalhe arteriovenoso ao exame de retina constituem
achados mais estreitamente associados à aterosclerose, que possuem
valor limitado como preditores do grau de severidade da hipertensão ou
para avaliação do risco CV geral.31
Exames laboratoriais
Os exames de laboratório são realizados para sustentar as metas gerais da avaliação inicial [Tabela 6].
Estes exames também fornecem informações basais que são úteis para o
monitoramento de pacientes que subsequentemente serão tratados com
fármacos anti-hipertensivos capazes de influenciar os valores
laboratoriais (p. ex., diuréticos, betabloqueadores, inibidores de
enzima conversora de angiotensina [ECA], bloqueadores do receptor da
angiotensina [BRA], inibidores de renina diretos). A realização de
exames adicionais não é recomendada, a menos que a história, o exame
físico ou exames laboratoriais iniciais sejam inconsistentes com a
hipertensão essencial ou sugiram uma etiologia secundária específica.
Se
a avaliação inicial sugerir a existência de disfunção renal, o paciente
deve ser avaliado quanto à existência de uma doença renal crônica, por
meio de urina de 24 horas para quantificar a excreção de proteínas e
estimar a taxa de filtração glomerular (TFG). Existem equações
disponíveis para estimar a TFG [Tabela 6]. A equação MDRD (modificação da dieta na doença renal – em inglês, modification
of diet in renal disease) requer a medida dos níveis sanguíneos de
ureia e das concentrações séricas de albumina, além da medida da
concentração sérica de creatinina.
Tabela 6. Avaliação laboratorial de pacientes hipertensos recém-diagnosticados
Objetivo
|
Exames
|
Identificação de fatores de risco CV
|
Colesterol (total, HDL); triglicerídeos; glicemia de jejum
|
Identificação de lesão em órgão-alvo
|
Radiografia de tórax; ECG; urinálise; níveis séricos de creatinina ou ureia, ácido úrico; microalbumina urinária
|
Rastreamento para detecção de hipertensão secundária
|
Níveis séricos de creatinina, potássio e cálcio; urinálise
|
Cálculo da função renal
|
Equação de Cockcroft e Gault:
TFG = (140 – idade em anos) × (peso em kg) × 0,85 (para paciente do sexo feminino)/72 × SCr
|
Equação MDRD:
TFG = 170 × (SCr)-0,999 × (idade em anos)-0,176 × 0,762 (para paciente do sexo feminino) × 1,18 (para paciente afrodescendente) × (ureia)-0,17 × (Alb)0,318
|
Alb
= concentração sérica de albumina (g/dL). ECG = eletrocardiograma. HDL =
lipoproteína de alta densidade (high density lipoprotein). MDRD (modificação da dieta na doença renal). SCr = creatinina sérica (mg/dL). TFG = taxa de filtração glomerular (mL/min).
Estratificação do risco
Seja
qual for o nível de PA, fatores específicos em um determinado paciente
individual podem produzir desvios acima ou abaixo da média do risco CV
observado nos estudos populacionais. Estes fatores são utilizados nas
diretrizes vigentes para determinar o limiar de PA e os tempos da
terapia farmacológica, bem como estabelecer a meta de PA a ser alcançada
individualmente por cada paciente.7,10,30 Os fatores
específicos individuais que determinam o risco são a existência de
outros fatores de risco CV e de lesão em órgãos-alvo ou a ocorrência de
uma doença CV clínica.12 Um esquema simples e modificado a
partir do Sixth Report of the Joint National Committee on Prevention,
Detection, Evaluation, and Treatment of High Blood Pressure (JNC 6)
agrupa os pacientes em 3 níveis de risco [Tabela 7].32
De acordo com esta abordagem, limiares de PA menores para iniciação da
terapia farmacológica e metas de PA mais baixas são recomendados para
pacientes que apresentam o maior nível de risco. Metas de PA mais altas,
por sua vez, são recomendadas para os pacientes que apresentam o menor
nível de risco. Exemplificando, em um paciente com diabetes, a terapia
farmacológica é recomendada (aliada à introdução de modificações no
estilo de vida) para os casos em que a PA ultrapassa 130/80 mmHg, e a
meta para tratamento são níveis inferiores a 130/80 mmHg. Em contraste,
para um paciente jovem que não apresenta outros fatores de risco CV,
evidências de lesão em órgão-alvo ou doença CV, a terapia inicial
recomendada consiste em modificações do estilo de vida, em vez do uso de
fármacos, a menos que a PA esteja no estágio 2 (PA sistólica = 160 mmHg
ou PA diastólica = 100 mmHg). Nestes casos de baixo risco, a meta de PA
são níveis inferiores a 140/90 mmHg. As diretrizes europeias descrevem
uma abordagem ainda mais detalhada para a estratificação do risco.10 É
importante notar que há poucas evidências fornecidas por estudos
prospectivos terapêuticos que justifiquem o uso da terapia farmacológica
no tratamento de casos de PA que estejam na faixa de pré-hipertensão.33,34
Soma-se a isto o fato de as evidências fornecidas pelos estudos
terapêuticos não sustentarem o valor de metas de tratamento mais
agressivas, além das metas de PA abaixo de 140/90 mmHg.35
Atualmente, a recomendação de se adotar um limiar menor de níveis de PA
para instituição da intervenção farmacológica, bem como metas de PA mais
agressivas baseadas no nível de risco CV geral e na existência de
certas comorbidades se baseia na opinião de especialistas e não em
estudos clínicos prospectivos. Um amplo estudo realizado recentemente,
envolvendo pacientes com diabetes de tipo 2, falhou em demonstrar os
benefícios proporcionados pela adoção de uma meta agressiva de PA
sistólica abaixo de 120 mmHg vs. a meta-padrão de PA abaixo de 140 mmHg.36
Os resultados deste estudo enfatizam a necessidade de se confirmarem as
estratégias terapêuticas baseadas no risco, por meio de estudos
clínicos prospectivos.
Tabela 7. Estratificação do risco e tratamento em casos de pacientes hipertensos
Estágio da PA (mmHg)
|
Grupo de risco A (ausência de fatores de risco, sem DOA/DCC*)
|
Grupo de risco B (= 1 fator de risco, excluído o diabetes; sem DOA/DCC)
|
Grupo de risco C (DOA/DCC e/ou diabetes ± outros fatores de risco)
|
Pré-hipertensão (120 a 139/80 a 89)
|
Modificação do estilo de vida
|
Modificação do estilo de vida
|
Modificação do estilo de vida, terapia farmacológica†
|
Estágio 1 (140 a 159/90 a 99)
|
Modificação do estilo de vida (até 12 meses)
|
Modificação do estilo de vida (até 6 meses)‡
|
Modificação do estilo de vida, terapia farmacológica
|
Estágio 2 (= 160/= 100)
|
Modificação do estilo de vida, terapia farmacológica
|
Modificação do estilo de vida, terapia farmacológica
|
Modificação do estilo de vida, terapia farmacológica
|
*Os
fatores de risco são: tabagismo, dislipidemia, diabetes, idade > 55
anos para homens, idade > 65 anos para mulheres, sexo masculino,
mulheres em pós-menopausa, história familiar de doença cardiovascular
(CV) prematura (mulheres < 65 anos, homens < 55 anos), nefropatia
(microalbuminúria ou taxa de filtração glomerular (TFG) < 60 mL/min),
obesidade (índice de massa corporal [IMC] = 30 kg/m2;
circunferência da cintura = 100 cm em homens e = 88 cm em mulheres),
níveis de proteína C reativa = 1 mg/dL, inatividade física., DOA (doença
em órgão alvo)/DCC (doença cardiovascular clínica) incluindo
hipertrofia ventricular esquerda (HVE), angina, episódio anterior de
infarto do miocárdio, insuficiência cardíaca, procedimento de
revascularização coronariana anterior, acidente vascular cerebral (AVC),
ataque isquêmico transiente, nefropatia, doença arterial periférica,
retinopatia.
†Usar
fármacos, quando pressão arterial (PA) sistólica > 130 mmHg ou a PA
diastólica > 80 mmHg e o paciente apresentar insuficiência cardíaca,
doença renal crônica ou diabetes.
‡Para
pacientes com múltiplos fatores de risco, considerar inicialmente os
fármacos em adição às modificações do estilo de vida.
Prevenção da hipertensão
O
risco de desenvolvimento de hipertensão é maior em afrodescendentes e
em todos os indivíduos com pré-hipertensão (22% da população adulta dos
Estados Unidos) ou história familiar de hipertensão. As características
reversíveis do paciente que estão associadas a um risco aumentado de
desenvolvimento de hipertensão incluem: sobrepeso ou obesidade; estilo
de vida sedentário; dieta rica em sódio e pobre em potássio; consumo
excessivo de bebidas alcoólicas; e síndrome metabólica.
Múltiplos estudos sustentam a efetividade da manipulação ambiental na prevenção ou retardo do aparecimento da hipertensão.37-41
A prevenção da hipertensão é importante, porque o tratamento de uma
hipertensão estabelecida é apenas parcialmente efetivo no que se refere à
diminuição da morbidade e mortalidade associadas. Além disso, a relação
existente entre o nível de PA e a morbidade e mortalidade CV é contínua
e estende-se aos níveis não hipertensivos. Cerca de 1/3 dos casos de
morte por doença arterial coronariana atribuíveis à PA envolvem pessoas
com PA na faixa pré-hipertensiva. As estratégias preventivas que
diminuem a PA em pacientes pré-hipertensos estendem os benefícios da
diminuição da PA a este grupo amplo.
O tratamento farmacológico da pré-hipertensão pode retardar o desenvolvimento da PA alta.42 Entretanto, o uso da terapia farmacológica para prevenção da hipertensão é desaconselhado.
Tratamento
A
meta geral do tratamento consiste em reduzir o risco de morbidade e
mortalidade CV, por meio da diminuição da PA e tratamento de outros
fatores de risco modificáveis. De modo geral, a meta de PA é uma medida
abaixo de 140/90 mmHg.7 Esta meta está associada a fortes
evidências obtidas em estudos clínicos de suporte. Em casos de pacientes
com diabetes, doença renal crônica, doença vascular comprovada (doença
vascular periférica, carotídea ou coronariana, aneurisma aórtico
abdominal) ou escore de risco de Framingham igual a 10% ou mais, a meta
de PA é uma medida inferior a 130/80 mmHg.30 Em casos de pacientes idosos com HSI, a meta é diminuir a PA sistólica para menos de 140 mmHg.7
Conforme já observado [ver Estratificação do risco, anteriormente],
estas metas de PA mais baixas carecem de uma base de sustentação de
evidências fortes. Também não há evidências fornecidas por estudos
clínicos sustentando uma meta de PA inferior a 140 mmHg para o
tratamento da HSI em idosos.33
As
metas de PA são alcançadas por meio da modificação do estilo de vida e,
na maioria dos casos, pela instituição de uma terapia farmacológica [Tabela 8].
Além disso, a existência de comorbidades (p. ex., dislipidemia ou
diabetes) deve ser abordada. A administração de aspirina em doses baixas
deve ser considerada, uma vez que a PA tenha sido controlada.43 A automedição da PA deve ser incentivada.24
Tabela 8. Fármacos anti-hipertensivos
Fármaco
|
Atributos
|
Agente
|
Dosagem |
Comentário
|
Diuréticos tiazídicos
|
Efeitos
colaterais gerais: hiponatremia, hipocalemia, hipomagnesemia,
hiperglicemia, hipercalcemia (diminuição da excreção urinária de
cálcio), hiperuricemia, aumento de triglicerídeos e colesterol,
diminuição da secreção de lítio.
Contraindicações: evitar o uso durante a gestação e por pacientes com gota.
O uso prolongado está associado a risco aumentado de desenvolvimento de diabetes de tipo 2
|
Hidroclorotiazida (HCTZ)
|
Dose inicial: 12,5 mg/dia; faixa: 12,5 a 50 mg/dia
|
Primeira
escolha em casos de hipertensão descomplicada e HSI (nota dos editores
do MedicinaNET – há melhores evidências de benefício com a clortalidona)
|
Clortalidomida
|
Dose inicial: 12,5 mg/dia; faixa: 12,5 a 25 mg/dia
|
Primeira
escolha em casos de hipertensão descomplicada e HSI (nota dos editores
do MedicinaNET – mais potente e com benefícios mais comprovados do que a
hidroclorotiazida)
| ||
Indapamida
|
Dose inicial: 1,25 mg/dia; faixa: 1,25 a 5 mg/dia
|
Uso em caso de insuficiência renal
| ||
Metolazona
|
Dose inicial: 1,25 mg/dia; faixa: 1,25 a 5 mg/dia
|
Uso em caso de insuficiência renal
| ||
Diuréticos de alça
|
Furosemida
|
Dose inicial: 20 mg/dia; faixa: 20 a 320 mg/dia
|
Diurético alternativo em casos de insuficiência renal; aumenta a excreção urinária de cálcio
| |
Bumetanida
|
Dose inicial: 0,5 mg/dia; faixa: 0,5 a 5 mg/dia
|
Diurético alternativo em casos de insuficiência renal; aumenta a excreção urinária de cálcio
| ||
Ácido etacrínico
|
Dose inicial: 25 mg/dia; faixa: 25 a 100 mg/dia
|
Diurético
alternativo em casos de insuficiência renal ou alergia a diuréticos à
base de sulfa; somente diuréticos que não sejam à base de sulfa; aumenta
a excreção urinária de cálcio
| ||
Torsemida
|
Dose inicial: 5 mg/dia; faixa: 5 a 20 mg/dia
|
Diurético
alternativo em casos de insuficiência renal; diurético de alça de ação
prolongada; aumenta a excreção urinária de cálcio
| ||
Diuréticos poupadores de potássio
|
Espironolactona
|
Dose inicial: 25 mg/dia; faixa 25 a 100 mg/dia
|
Poupador
de potássio; antagonista de aldosterona (bloqueador de receptor de
mineralocorticoide); evitar o uso em casos de insuficiência renal.
Efeitos colaterais específicos: hipercalemia, hiponatremia, ginecomastia
dolorosa, irregularidades menstruais
Disponibilizado em formulação combinada ao HCTZ
| |
Eplerenona
|
Dose inicial: 50 mg/dia; faixa: 50 a 100 mg/dia
|
Poupador
de potássio; antagonista de aldosterona (bloqueador de receptor de
mineralocorticoide); menos efeitos colaterais antiandrogênicos do que a
espironolactona; evitar o uso em casos de insuficiência renal. Efeitos
colaterais específicos: hipercalemia, hiponatremia. Diminuir a dose pela
metade em casos de paciente sob tratamento com verapamil
| ||
Triamtereno
|
Dose inicial: 50 mg/dia; faixa: 50 a 150 mg/dia
|
Poupador
de potássio; utilizado em geral na prevenção da hipocalemia induzida
por diurético. Efeitos colaterais específicos: hipercalemia,
nefrolitíase. Disponibilizado em formulação combinada ao HCTZ
| ||
Amilorida
|
Dose inicial: 5 mg/dia; faixa: 5 a 10 mg/dia
|
Poupador
de potássio; utilizado em geral na prevenção da hipocalemia induzida
por diurético. Efeitos colaterais específicos: hipercalemia.
Disponibilizado em formulação combinada ao HCTZ
| ||
Antagonistas de cálcio
|
Fármacos alternativos de primeira linha.
Efeitos colaterais gerais: cefaléia, edema, hiperplasia gengival
|
Diltiazem (liberação estendida)
|
Dose inicial: 120 mg/dia; faixa: 120 a 480 mg/dia
|
Efeitos colaterais adicionais: constipação, bloqueio AV, bradicardia, insuficiência cardíaca
|
Verapamil (liberação estendida)
|
Dose inicial: 120 mg/dia; faixa: 120 a 480 mg/dia
|
Efeitos colaterais adicionais: constipação, bloqueio AV, bradicardia, insuficiência cardíaca
| ||
Nifedipina (liberação estendida)
|
Dose inicial: 30 mg/dia; faixa: 30 a 90 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia
| ||
Amlodipina
|
Dose inicial: 2,5 mg/dia; faixa: 2,5 a 10 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia
| ||
Nicardipina (liberação estendida)
|
Dose inicial: 60 mg/dia; faixa: 60 a 120 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia
| ||
Felodipina
|
Dose inicial: 2,5 mg/dia; faixa: 2,5 a 10 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia
| ||
Isradipina (liberação estendida)
|
Dose inicial: 5 mg/dia; faixa: 5 a 10 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia
| ||
Nisoldipina
|
Dose inicial: 10 mg/dia; faixa: 10 a 60 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia
| ||
Betabloqueadores
|
Fármacos
alternativos de primeira linha para pacientes mais jovens. (nota dos
editores do MedicinaNET – grupos de especialistas tem questionado o uso
desta classe de medicações como fármacos de primeira linha). Efeitos
colaterais gerais: fadiga, bradicardia, diminuição da tolerância ao
exercício, broncoespasmo, sonhos vívidos, diminuição dos níveis de HDL,
aumento dos níveis de triglicerídeos, insônia, sintomas mascarados e
atraso da recuperação da hipoglicemia em diabéticos.
O uso prolongado está associado ao risco aumentado de diabetes do tipo 2
|
Propranolol
|
Dose inicial: 40 mg/dia; faixa: 40 a 240 mg/dia
|
|
Propranolol (liberação estendida)
|
Dose inicial: 60 mg/dia; faixa: 60 a 240 mg/dia
|
|||
Metoprolol fumarato
|
Dose inicial: 50 mg/dia; faixa: 50 a 200 mg/dia
|
|||
Metoprolol succinato
|
Dose inicial: 50 mg/dia; faixa: 50 a 400 mg/dia
|
|||
Atenolol
|
Dose inicial: 25 mg/dia; faixa: 25 a 100 mg/dia
|
|||
Bisoprolol
|
Dose inicial: 5 mg/dia; faixa: 5 a 20 mg/dia
|
|||
Nadolol
|
Dose inicial: 20 mg/dia; faixa: 20 a 320 mg/dia
|
|||
Timolol
|
Dose inicial: 10 mg/dia; faixa: 10 a 40 mg/dia
|
|||
Acebutolol
|
Dose inicial: 200 mg/dia; faixa: 200 a 1.200 mg/dia
|
Efeitos colaterais adicionais: atividade simpatomimética intrínseca, resultando em menos bradicardia e alterações lipídicas.
Associado à positividade para ANA e lúpus fármaco-induzido
| ||
Pindolol
|
Dose inicial: 10 mg/dia; faixa: 10 a 60 mg/dia
|
Efeitos colaterais adicionais: atividade simpatomimética intrínseca, resultando em menos bradicardia e alterações lipídicas
| ||
Labetalol
|
Dose inicial: 200 mg/dia; faixa: 200 a 1.200 mg/dia
|
Atividade de alfa-1-bloqueador. Efeitos colaterais adicionais: hipotensão ortostática, hepatotoxicidade
| ||
Nebivolol
|
Dosagem: 5 a 40 mg/dia
|
Altamente cardiosseletivo; causa vasodilatação a partir da geração de óxido nítrico
| ||
Carvedilol
|
Dose inicial: 200 mg/dia; faixa: 200 a 1.200 mg/dia
|
Atividade de alfa-1-bloqueador. Efeitos colaterais adicionais: hipotensão ortostática, hepatotoxicidade
| ||
Inibidores de ECA
|
Fármacos
de primeira linha alternativos. Efeitos colaterais gerais: tosse,
angioedema, hipercalemia, insuficiência renal aguda (em caso de estenose
arterial renal bilateral).
Uso contraindicado durante a gestação
|
Captopril
|
Dose inicial: 12,5 mg/dia; faixa: 12,5 a 100 mg/dia
|
Efeitos
colaterais adicionais: distúrbios do paladar, leucopenia, proteinúria
com lesão glomerular membranosa secundária ao grupo sulfidrila; somente
inibidores de ECA à base de sulfa
|
Enalapril
|
Dose inicial: 2,5 mg/dia; faixa: 2,5 a 40 mg/dia
| |||
Lisinopril
|
Dose inicial: 5 mg/dia; faixa: 5 a 40 mg/dia
| |||
Benazepril
|
Dose inicial: 10 mg/dia; faixa: 10 a 80 mg/dia
| |||
Fosinopril
|
Dose inicial: 10 mg/dia; faixa: 10 a 40 mg/dia
| |||
Moexipril
|
Dose inicial: 7,5 mg/dia; faixa: 7,5 a 30 mg/dia
| |||
Perindopril
|
Dose inicial: 4 mg/dia; faixa: 4 a 8 mg/dia
| |||
Quinapril
|
Dose inicial: 5 mg/dia; faixa: 5 a 80 mg/dia
| |||
Ramipril
|
Dose inicial: 1,25 mg/dia; faixa: 1,25 a 20 mg/dia
| |||
Trandolapril
|
Dose inicial: 1 mg/dia; faixa: 1 a 4 mg/dia
| |||
Antagonistas do receptor da angiotensina II
|
Fármacos
de primeira linha alternativos ao uso de inibidores de ECA. Efeitos
colaterais gerais: angioedema (raro); não causam tosse
|
Losartan
|
Dose inicial: 25 mg/dia; faixa: 25 a 100 mg/dia
|
|
Valsartan
|
Dose inicial: 80 mg/dia; faixa: 80 a 320 mg/dia
|
|||
Irbesartan
|
Dose inicial: 150 mg/dia; faixa: 150 a 300 mg/dia
|
|||
Candesartan
|
Dose inicial: 8 mg/dia; faixa: 8 a 32 mg/dia
|
|||
Eprosartan
|
Dose inicial: 400 mg/dia; faixa: 400 a 800 mg/dia
|
|||
Telmisartan
|
Dose inicial: 40 mg/dia; faixa: 40 a 80 mg/dia
|
|||
Olmesartan
|
Dose inicial: 20 mg/dia; faixa: 20 a 40 mg/dia
|
|||
Atividade de alfa1-bloqueador
|
Terapia
adicional; não podem ser utilizados como fármacos de primeira linha
para monoterapia. Efeitos colaterais gerais: hipotensão ortostática;
edema; síncope com a primeira dose (tomar no momento de dormir)
|
Prazosina
|
Dose inicial: 1 mg/dia; faixa: 1 a 20 mg/dia
|
|
Doxazosina
|
Dose inicial: 1 mg/dia; faixa: 1 a 16 mg/dia
|
|||
Terazosina
|
Dose inicial: 1 mg/dia; faixa: 1 a 20 mg/dia
|
|||
Prazosina
|
Dose inicial: 1 mg/dia; faixa: 1 a 20 mg/dia
|
|||
Agonistas alfa-adrenérgicos centrais
|
Terapia
adicional; usar como fármacos secundários combinados a um diurético.
Efeitos colaterais gerais: sedação, fadiga, boca seca, bradicardia,
bloqueio cardíaco, retenção de líquido, hipertensão de rebote com a
suspensão repentina do uso
|
Clonidina
|
Dose inicial: 0,1 mg/dia; faixa: 0,1 a 0,6 mg/dia
|
|
Clonidina (adesivo transdérmico)
|
Dose inicial: 0,1 mg/dia; faixa: 0,1 a 0,3 mg/dia
|
Menor
probabilidade de haver hipertensão de rebote do que com o uso da
formulação oral. Efeitos colaterais adicionais: dermatite de contato
causada pelo adesivo
| ||
Metildopa
|
Dose inicial: 250 mg/dia; faixa: 250 a 2.000 mg/dia
|
Efeitos
colaterais adicionais: pode causar hepatite, anemia hemolítica
Coombs-positiva, síndrome do tipo lúpica, discrasias sanguíneas
| ||
Guanfacina
|
Dose inicial: 1 mg/dia; faixa: 1 a 2 mg/dia
|
Tomar no momento de ir dormir, para amenizar a sedação
| ||
Guanabenz
|
Dose inicial: 4 mg/dia; faixa: 4 a 64 mg/dia
|
|||
Vasodilatadores diretos
|
Utilizados
como fármacos terciários em combinação com um diurético e um inibidor
adrenérgico. Efeitos colaterais gerais: cefaléia, retenção de líquido
|
Hidralazina
|
Dose inicial: 40 mg/dia; faixa: 40 a 200 mg/dia
|
Efeitos colaterais adicionais: rubor, taquicardia, congestão nasal, hepatite, síndrome do tipo lúpica
|
Minoxidil
|
Dose inicial: 2 mg/dia; faixa: 2,5 a 40 mg/dia
|
Uso
em casos de hipertensão resistente. Efeitos colaterais adicionais:
taquicardia; retenção de líquido significativa, cujo controle requer uso
de diurético de alça; efusão pericárdica; crescimento de pelos
| ||
Inibidores de renina diretos
|
Geralmente, bem tolerados
|
Aliskerina
|
Dose inicial: 150 mg/dia; faixa: 150 a 300 g/dia
|
Seu
papel no tratamento é incerto. Efeitos colaterais adicionais: diarreia,
cefaléia, angioedema, hipercalemia. Uso contraindicado durante a
gestação. Diminui os níveis sanguíneos da furosemida
|
ANA = anticorpo
antinúcleo. AV = atrioventricular. ECA = enzima conversora de
angiotensina (angiotensin-converting enzyme). HCTZ = hidroclorotiazida.
HDL = lipoproteína de alta densidade (high-density lipoprotein). HSI =
hipertensão sistólica isolada.
Fatores relacionados ao estilo de vida
Estudos
observacionais identificaram vários fatores ambientais associados à
hipertensão, ao passo que estudos prospectivos demonstraram que é
possível diminuir a PA por meio da manipulação destes fatores [Tabela 9].37,39-41,44-47
Além de diminuir a PA, as recomendações relativas ao estilo de vida
destinam-se a reduzir o risco CV de uma forma geral. Tais ações devem
ser recomendadas a todos os pacientes com PA acima do nível normal. O
tabagismo deve ser combatido, pois além de ser um poderoso fator de
risco CV, cada cigarro fumado promove uma elevação da PA que dura 15 a
30 minutos, sendo que múltiplos cigarros podem manter a PA elevada
durante a maior parte do dia. Foi demonstrado que um dispositivo que
facilita os exercícios de respiração profunda (RESPeRATE) diminui a PA e
pode ser considerado auxiliar para os tratamentos baseados em fármacos e
modificação do estilo de vida.48
Tabela 9. Modificações do estilo de vida para prevenção e tratamento da hipertensão
Perder peso (se estiver com sobrepeso)
|
Diminuir a ingesta de sódio para = 100 mmol/dia (2,4 g de sódio, 6 g de sal)
|
Intensificar a prática de exercícios aeróbicos (30 a 45 min/dia)
|
Limitar
a ingesta diária de álcool a no máximo 30 mL (p. ex., 700 mL de
cerveja, 300 mL de vinho, 60 mL de uísque ou, no caso das mulheres e
indivíduos mais magros, 15 mL
|
Manter uma ingesta adequada de potássio (90 mmol/dia)
|
Ingerir
dieta rica em frutas e verduras, contendo produtos com baixo teor de
gordura e pobres quanto ao conteúdo de gorduras saturadas e totais (p.
ex., dieta DASH)
|
Abandonar o tabagismo
|
DASH = abordagem dietética para interromper a hipertensão (em inglês, dietary approaches to stop hypertension).
Tratamento farmacológico
As
diretrizes atuais recomendam para a maioria dos pacientes o uso de
diuréticos tiazídicos como fármacos de escolha iniciais. Esta
recomendação baseia-se na totalidade dos dados fornecidos por estudos
randomizados, entre os quais o Antihypertensive and Lipid Lowering
Treatment to Prevent Heart Attack Trial (ALLHAT).7,49–51
Aqueles que criticam o uso de diuréticos mencionam evidências sugestivas
de que o tratamento à base de diuréticos não protege contra os eventos
da doença arterial coronariana na intensidade prevista pelos estudos
epidemiológicos. O ALLHAT foi planejado para determinar se o tratamento
com um diurético (o diurético utlizado no estudo foi a clortalidona)
seria inferior ao tratamento com um alfabloqueador, um antagonista de
cálcio ou um inibidor de ECA em termos de prevenção dos eventos fatais e
não fatais da doença arterial coronariana em indivíduos adultos com
hipertensão essencial, pertencentes a um grupo de alto risco. Este
estudo mostrou que os fármacos avaliados não diferem entre si quanto aos
resultados fatal e não fatal da doença arterial coronariana, nem em
termos de mortalidade total, independentemente da raça do paciente.52
Além disso, o tratamento com diurético apresentou desempenho superior
ao dos tratamentos com alfabloqueador, antagonista de cálcio ou inibidor
de ECA no caso de alguns resultados da doença CV. O ramo alfabloqueador
do estudo foi concluído mais cedo, porque se observou um aumento de
quase 2 vezes no risco de desenvolvimento de insuficiência cardíaca, em
comparação ao observado no grupo tratado com diurético. Tendo estes
resultados como base, os alfabloqueadores deixaram de ser considerados
uma terapia inicial apropriada para a hipertensão. Em comparação com o
grupo tratado com diuréticos, o grupo tratado com antagonista de cálcio
também apresentou risco aumentado de insuficiência cardíaca. O grupo
tratado com inibidor de ECA, comparado ao grupo tratado com diuréticos,
apresentou maior risco de desenvolvimento de AVC e doença CV combinada,
porém grande parte dos casos de aumento de risco envolveu pacientes
afrodescendentes, que apresentavam um controle de PA com inibidor de ECA
inferior ao controle alcançado com o uso de diuréticos. Uma análise
recente dos dados fornecidos pelo ALLHAT avaliou os casos de internação
incidental por insuficiência cardíaca com preservação ou diminuição da
fração de ejeção. O tratamento com diurético diminuiu significativamente
o risco de insuficiência cardíaca com fração de ejeção preservada, em
comparação ao tratamento com antagonista de cálcio, inibidor de ECA ou
alfabloqueador. O diurético também diminuiu o risco de insuficiência
cardíaca com ejeção diminuída, em comparação ao antagonista de cálcio e
ao alfabloqueador.53 Além disso, não houve evidências de que
os bloqueadores de canais de cálcio ou inibidores de ECA tenham sido
superiores ao diurético tiazídico como terapia inicial em casos de
pacientes com diabetes melito ou doença renal crônica.54,55
Uma revisão sistemática de estudos terapêuticos randomizados confirmou
que os diuréticos tiazídicos apresentaram mais evidências de benefícios
CV no tratamento da hipertensão.56
Medicamentos
alternativos devem ser considerados nos casos em que o uso de diurético
for contraindicado ou precariamente tolerado, ou quando houver
indicação para uso de um fármaco de outra classe. As opções de fármacos
existentes são betabloqueadores, inibidores de ECA, BRA e antagonistas
de cálcio. Com base nas evidências, os inibidores de ECA são os que
fornecem mais evidências de benefícios CV, entre os fármacos
alternativos.56
Um
estudo publicado depois do ALLHAT sugeriu que os inibidores de ECA eram
superiores aos diuréticos no tratamento de homens idosos.57
Na verdade, é provável que as diferenças apresentadas pelos fármacos
alternativos em termos de resultados reflitam as diferenças de PA
alcançada, em vez dos efeitos exclusivos dos agentes específicos.58 Assim, alcançar uma meta de PA é mais importante do que os agentes específicos utilizados para atingir esta meta.59
É
controverso o papel dos betabloqueadores como forma alternativa de
tratamento inicial de casos de hipertensão sem complicação. Duas
metanálises constataram que o efeito produzido pelos betabloqueadores é
inferior ao ideal, se comparado ao efeito produzido por outros fármacos
anti-hipertensivos sobre os resultados e mortalidade CV.60,61
Estas revisões concluíram que os betabloqueadores não devem continuar
sendo considerados opções de primeira escolha para o tratamento da
hipertensão sem complicação. Entretanto, outra metanálise descobriu
também a existência de um risco relativamente maior, em particular de
desenvolvimento de AVC, entre pacientes com idade = 60 anos, embora
tenha concluído que entre pacientes mais jovens o uso de
betabloqueadores está associado a uma redução significativa da morbidade
e mortalidade CV.62
Estudos
clínicos randomizados sugerem que a existência de certas comorbidades
constitui uma indicação “convincente” para a indicação da escolha de
determinados fármacos específicos [Tabela 10].
Outras considerações que devem influenciar a seleção do fármaco incluem
a existência de condições concomitantes para as quais certos agentes
podem ser benéficos e outros, contraindicados [Tabelas 10 e 11];
potenciais interações fármaco-fármaco; aspectos preocupantes sobre a
qualidade de vida; e custo (existem formulações genéricas disponíveis de
diuréticos, betabloqueadores, antagonistas de cálcio, inibidores de ECA
e BRA). Por fim, a demografia deve ser considerada: em geral, pacientes
idosos e afrodescendentes respondem melhor aos diuréticos e
antagonistas de cálcio; pacientes mais jovens e brancos, por sua vez,
respondem melhor aos betabloqueadores, inibidores de ECA e BRA. De modo
geral, o fármaco escolhido deve ter meia-vida longa (uma dose diária é
preferível). Este fármaco deve ser continuado somente se o paciente
apresentar tolerância e se sentir confortável com seu custo, pois estes
fatores são importantes para a aderência a longo prazo. Para alcançar a
meta de níveis de PA atualmente recomendados, muitos pacientes
necessitarão de mais de um fármaco. Esta possibilidade deve ser
discutida com o paciente logo no início. Independentemente do agente
escolhido, a PA deve ser reavaliada após 2 a 4 semanas de tratamento [Figura 1].
Tabela 10. Condição do paciente e escolha de fármacos anti-hipertensivos
Condição
|
Escolha do fármaco
|
Sem comorbidades
|
Diuréticos
|
HSI (pacientes idosos)
|
Diuréticos (preferível), antagonistas de cálcio (diidropiridínicos)*
|
Angina
|
Betabloqueadores*, antagonistas de cálcio (diidropiridínicos que não tenha ação de curta duração)
|
Angina (com diabetes ou disfunção VE)
|
Inibidores de ECA† (em adição aos betabloqueadores e antagonistas de cálcio)
|
Fibrilação atrial
|
Betabloqueadores*, antagonistas de cálcio (limitadores de frequencia)*†
|
Tosse com inibidores de ECA
|
BRA*
|
Diabetes melito de tipo 1, com proteinúria
|
Inibidores de ECA*; antagonistas de cálcio (não diidropiridínicos); diuréticos, betabloqueadores†
|
Diabetes melito de tipo 2, com proteinúria
|
BRA*†, antagonistas de cálcio (não diidropiridínicos)†; diuréticos, betabloqueadores†
|
Alto risco de diabetes melito de tipo 2
|
Inibidores de ECA†
|
Tremor essencial
|
Betabloqueadores (não cardiosseletivos) †
|
Insuficiência cardíaca, disfunção VE
|
Inibidores
de ECA, betabloqueadores, diuréticos, antagonistas da aldosterona*;
BRA†; hidralazina (combinada a nitratos de ação prolongada); geralmente,
um inibidor de ECA com um betabloqueador aprovado para pacientes com
FEVE diminuída (estágio B); diurético utilizado no tratamento da
congestão; antagonista de aldosterona usado apenas em casos de doença em
estágio avançado, combinado a outros agentes (não é recomendado o uso
combinado de inibidor de ECA, BRA e antagonista de aldosterona);
hidralazina com um nitrato de ação de longa duração é alternativa para
pacientes em estágio C, com FEVE diminuída, que sejam intolerantes aos
inibidores de ECA e ao BRA
|
Alto risco de doença CV ou diabetes melito de tipo 2
|
Inibidores de ECA†
|
Hiperlipidemia
|
Alfabloqueadores (não são considerados agentes de tratamento de primeira linha)†
|
Intolerância a outros fármacos anti-hipertensivos
|
BRA†
|
HVE (por ECG)
|
BRA†
|
Enxaqueca
|
Betabloqueadores (não cardiosseletivos), antagonistas de cálcio (não diidropiridínicos)†
|
Infarto do miocárdio
|
Um
betabloqueador (sem ASI) é mais frequentemente o fármaco de escolha,
com um inibidor de ECA adicionado em caso de comprometimento da função
VE*; um antagonista da aldosterona pode ser adicionado à terapia-padrão,
em caso de disfunção VE*; diltiazem (infarto sem onda Q)†; verapamil†
|
Osteoporose
|
Diuréticos tiazídicos†
|
Doença vascular periférica
|
Antagonistas de cálcio†
|
Hipertensão pré-operatória, diante de risco CV aumentado
|
Betabloqueadores†
|
AVC anterior
|
Diuréticos
+ inibidor de ECA*; o inibidor de ECA como monoterapia não exerce
efeito sobre a PA ou o resultado; benefícios notados apenas com o uso
combinado, que diminuiu a PA
|
Prostatismo
|
Alfabloqueadores (não são considerados agentes de tratamento de primeira linha)†
|
Insuficiência renal com proteinúria de causa diversa
|
Inibidores de ECA, BRA, antagonistas de cálcio (não diidropiridínicos)†
|
*Indicação convincente.
†Indicação específica.
ASI
= atividade simpatomimética intrínseca. AVC = acidente vascular
cerebral. BRA = bloqueador do receptor da angiotensina II. CV =
cardiovascular. ECA = enzima conversora de angiotensina. ECG =
eletrocardiograma. FEVE = fração de ejeção ventricular esquerda. HSI =
hipertensão sistólica isolada. HVE = hipertrofia ventricular esquerda.
PA = pressão arterial. VE = ventrículo esquerdo.
Tabela 11. Contraindicações ao uso de fármacos anti-hipertensivos
Classe de fármaco
|
Possíveis contraindicações
|
Contraindicações convincentes
|
Diuréticos
|
Dislipidemia
(doses altas), alergia a antibióticos à base de sulfa, paciente do sexo
masculino e sexualmente ativo, diabetes melito (doses altas)
|
Gota, alergia a diuréticos à base de sulfa
|
Betabloqueadores
|
Doença
broncoespástica (asma, DPOC, agentes não cardiosseletivos),
dislipidemia (agentes sem ASI), doença vascular periférica grave,
atletas
|
Doença broncoespástica (agentes não cardiosseletivos), bloqueio cardíaco de 2º ou 3º grau
|
Inibidores de ECA, BRA
|
Doença renovascular (estenose arterial renal bilateral), insuficiência renal
|
Gestação, hipercalemia
|
Antagonistas de cálcio
|
–
|
Bloqueio cardíaco de 2º ou 3º grau (agentes não diidropiridínicos), insuficiência cardíaca (exceto amlodipina, felodipina)
|
Alfabloqueadores
|
Hipotensão postural
|
Incontinência urinária
|
Reserpina
|
Úlcera péptica, alergia nasal
|
Depressão
|
Metildopa
|
Doença hepática
|
–
|
Labetalol
|
Doença hepática
|
–
|
Alfa-agonistas centrais
|
Depressão, distúrbios do sono
|
–
|
ASI = atividade simpatomimética intrínseca. BRA = bloqueadores do receptor da angiotensina.
ECA = enzima conversora de angiotensina (angiotensin-converting
enzyme). DHP = desidropiridina. DPOC = doença pulmonar obstrutiva
crônica.

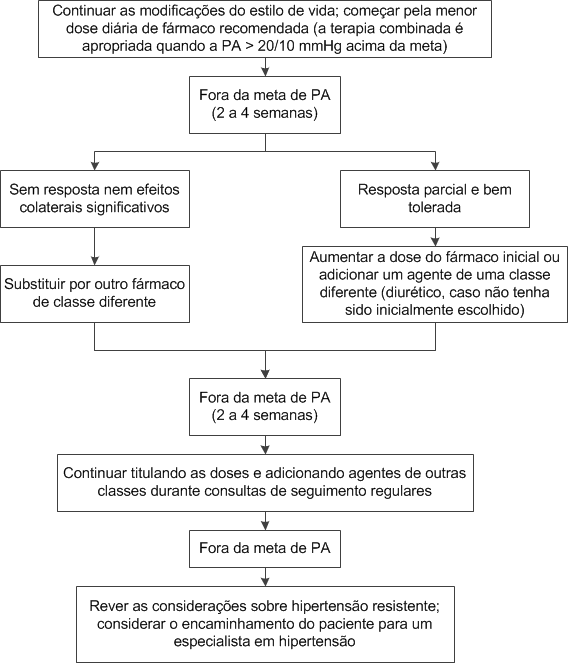
Figura 1. Abordagem da terapia farmacológica para casos de hipertensão.
Terapia de combinação
O
relatório do JNC 7 sugere a iniciação da terapia com 2 fármacos
(terapia de combinação), em vez de um único agente, caso a PA sistólica
exceda em mais 20 mmHg ou a PA diastólica exceda em mais de 10 mmHg a
meta de PA do tratamento.7 O relatório recomenda que o regime
de 2 fármacos inclua 1 diurético apropriado para o nível de função
renal do paciente. Entretanto, um estudo realizado em 2005, envolvendo
pacientes hipertensos de alto risco, com idades entre 40 e 79 anos,
demonstrou que a terapia de combinação com bloqueador de canais de
cálcio e inibidor de ECA preveniu novos eventos CV significativos e
induziu menos diabetes do que a terapia com 1 betabloqueador e 1
diurético.63 Em um estudo mais recente, envolvendo pacientes
hipertensos de alto risco, a terapia de combinação com 1 bloqueador de
canais de cálcio e 1 inibidor de ECA preveniu mais eventos CV do que a
combinação de 1 inibidor de ECA com 1 diurético.64 Em uma
análise subsequente dos dados obtidos por este estudo, constatou-se que a
combinação bloqueador de canais de cálcio/inibidor de ECA também foi
superior à combinação inibidor de ECA/diurético em termos de promoção de
retardo da doença renal progressiva.65 Embora estes estudos
sustentem o uso de combinações de 2 fármacos que não incluam um
diurético, um amplo estudo levantou questões sobre a segurança da
terapia de combinação com inibidor de ECA e BRA. Neste estudo, a
combinação apresentou associação com efeitos colaterais mais
significativos, incluindo hipercalemia e comprometimento renal. Com base
nos achados deste estudo, o uso desta combinação passou a ser
desestimulado.66
Um número crescente de combinações de produtos anti-hipertensivos tem sido disponibilizado em diversas opções de dosagem.7
Um metanálise recente demonstrou que o efeito sobre a PA observado com o
uso das combinações foi similar ao efeito que se esperaria obter se os
efeitos das monoterapias componentes fossem aditivos.67
Embora os produtos de combinação possam ser mais convenientes, muitas
vezes é mais econômico usar agentes individuais, porque os fármacos
componentes frequentemente são disponibilizados em formas genéricas.
Além disso, a titulação de doses de agentes individuais pode ser mais
fácil quando 2 fármacos são prescritos separadamente. Uma vez alcançado o
controle da PA com determinadas doses de ambos os agentes, torna-se
possível considerar a mudança para a mesma terapia na forma combinada
para melhorar a aderência, caso o custo desta não seja proibitivo.
O uso da terapia de combinação em casos de hipertensão foi revisto recentemente.68
Recomenda-se ter cautela ao usar a terapia de combinação de fármacos
como terapia inicial para pacientes idosos e diabéticos, que podem
apresentar disfunção autonômica, devido ao risco aumentado de quedas
abruptas da PA ou agravamento da hipotensão ortostática.
Melhora das taxas de controle
Um progresso substancial foi alcançado em termos de controle da hipertensão, nos Estados Unidos.1
As estimativas atuais de controle da PA atendem às metas mínimas de 50%
do Healthy People 2010. Entretanto, ainda há um número significativo de
pessoas que apresentam risco de morbidade e mortalidade CV prematura em
decorrência de hipertensão descontrolada. É comum acreditar que as
principais barreiras ao controle da PA são a falta de acesso à
assistência de saúde e a não adesão dos pacientes. Também se acredita
que a população de pacientes com hipertensão descontrolada abrange
números desproporcionalmente grandes de minorias étnicas e raciais. No
entanto, estudos sugerem que existem outros fatores igualmente
importantes. As análises realizadas pelo Third National Health and
Nutrition Examination Survey (NHANES III) identificaram fatores
associados à probabilidade tanto de se obter o controle da hipertensão
como de não se conseguir controlar esta condição.69 Os
fatores associados a uma maior probabilidade de controle da hipertensão
foram: estado civil casado (maior suporte social), ter seguro de saúde
particular, consultar-se sempre no mesmo estabelecimento de assistência
médica ou consultar-se sempre com o mesmo prestador de assistência ao
longo do tempo, ter tomado medidas da PA nos últimos 6 a 11 meses e
adotar as modificações do estilo de vida indicadas pelo programa de
tratamento. Os fatores associados a uma probabilidade maior de falha em
controlar a hipertensão, por sua vez, foram: idade = 65 anos, sexo
masculino, raça negra e ter faltado às consultas médicas no ano
anterior. Notavelmente, não ter um seguro de saúde ou uma fonte de
assistência médica não constituiu um fator preditivo de hipertensão
descontrolada.
Com
base na revisão de estudos clínicos que avaliaram potenciais
intervenções para melhorar as taxas de controle da hipertensão,
concluiu-se que as clínicas comunitárias deveriam ter um sistema de
seguimento e revisão regular de pacientes com hipertensão.70 A
terapia farmacológica deve ser fornecida por meio de uma abordagem em
etapas, e os pacientes devem ser incentivados a realizar o
automonitoramento da PA. Além disso, lembretes de compromissos podem ser
úteis. Um algoritmo de tratamento baseado na assistência em etapas,
utilizando uma terapia de combinação com uma dose inicial baixa fixa,
foi comparado a uma abordagem baseada em diretrizes de um grupo de
clínicas de prática familiar do Canadá.71 Neste estudo, o
algoritmo de tratamento foi associado a uma taxa mais alta de controle
da PA, reforçando o valor de uma abordagem terapêutica simples e em
etapas para melhorar as taxas de controle da PA na prática clínica. Os
prestadores de assistência de saúde devem considerar as etapas a serem
seguidas para melhorar as taxas de controle em suas respectivas práticas
[Tabela 12].
Tabela 12. Considerações para melhorar as taxas de controle da PA
Familiarizar-se com as diretrizes nacionais (estabelecer uma meta de PA com o paciente)
|
Agendar consultas regulares de seguimento e considerar o uso de lembretes de compromissos
|
Recomendar o automonitoramento da PA (envolver os pacientes no processo de tratamento)
|
Medir
a PA a cada consulta de seguimento, no consultório, e articular uma
recomendação terapêutica caso a PA esteja acima da meta
|
Enfatizar
os fatores relacionados ao estilo de vida como parte do programa de
tratamento (envolver os pacientes no processo de tratamento); rever os
avanços e as barreiras a cada consulta
|
Usar
doses adequadas de fármacos anti-hipertensivos; estar disposto a usar
múltiplos fármacos e empregar um algoritmo estruturado de tratamento
baseado na assistência em etapas
|
Estimular a comunicação, no que se refere aos custos e efeitos colaterais da medicação
|
Estar alerta para as taxas de controle precárias entre pacientes do sexo masculino, idosos e afrodescendentes
|
PA = pressão arterial.
Hipertensão resistente
Estudos
realizados para determinar as causas da hipertensão resistente
empregaram definições diferentes do termo. Na maioria dos estudos, a
hipertensão foi considerada resistente ou refratária quando o controle
não era alcançado com o uso de uma combinação de modificações de estilo
de vida e o uso racional de doses terapêuticas integrais de 2 ou 3
medicamentos anti-hipertensivos, um dos quais era um diurético
apropriado para o nível de função renal do paciente. Nos estudos
clínicos, a prevalência da hipertensão resistente foi de 20 a 30%. As
características associadas à hipertensão resistente incluem a idade
avançada, obesidade, doença renal crônica, HVE, diabetes, raça negra,
sexo feminino e elevada ingesta dietética de sódio. Vários aspectos
devem ser considerados na avaliação do pacientes com hipertensão
resistente:72 falta de complacência com a terapia,
substâncias interferentes, regime farmacológico inapropriado,
hipertensão do avental branco ou pseudo-hipertensão, hipertensão
secundária. Na maioria dos casos, os fatores causativos serão
identificados se estes 5 aspectos forem cuidadosamente considerados.
Falta de complacência
A
falta de controle da PA muitas vezes resulta da falta de aderência do
paciente ao regime farmacológico ou dietético. Os motivos comuns para a
falta de adesão ao regime farmacológico incluem o custo dos
medicamentos, efeitos colaterais, esquemas de dosagem complicados e
seguimento inadequado. Os pacientes relutam em admitir sua falta de
complacência com a terapia farmacológica, sendo por isso necessário um
alto grau de vigilância. Fazer perguntas abertas, como “Muitas pessoas
têm problemas para se lembrar do esquema de dosagem, e você?”,
ocasionalmente é efetivo. Os indícios de falta de complacência incluem a
falha em comparecer aos seguimentos agendados ou em renovar as
prescrições, ou queixas referentes ao custo dos fármacos ou seus efeitos
colaterais. Espera-se que alguns fármacos produzam efeitos observáveis
ao exame físico ou por meio de exames laboratoriais. A ausência destes
achados pode indicar falta de complacência. Alguns exemplos são a
diminuição da frequência cardíaca por ação dos betabloqueadores, as
alterações eletrolíticas promovidas pelos diuréticos e o ressecamento da
boca causado pela clonidina. A falta de aderência a uma dieta pobre em
sal também pode ser importante. Uma dieta rica em sal pode interferir na
efetividade de quase todos os fármacos anti-hipertensivos atualmente
utilizados.

Nenhum comentário:
Postar um comentário